Քիմիա
Կազմե ́ք ռեակցիաների հավասարումներ, որոնց օգնությամբ հնարավոր է իրականացնել հետեւյալ փոխարկումները.
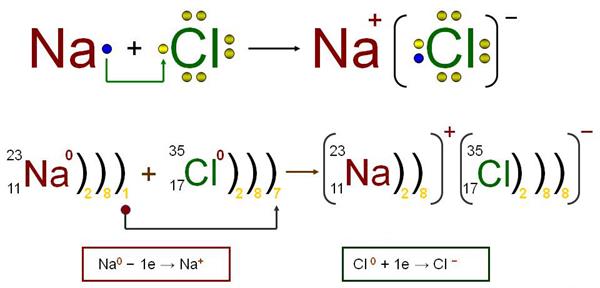
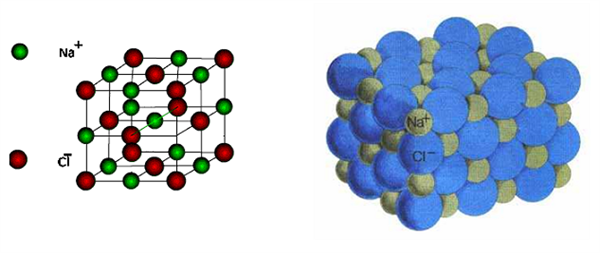
Na—»Na2O— »NaCl
C —»CO2 —»H2CO3
Na+O2=Na2O Na2O+HCl=NaCl + H2O
CO2+H2O=H2CO3
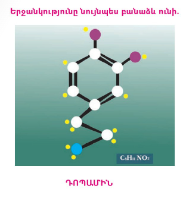
2. Որոշել նատրիումի կարբոնատում Na₂CO₃ ածխածին տարրի զանգվածային բաժինը:
Mr=(Na2CO3)=2Ar(Na)+Ar(C)+3Ar(O)=46+12+48= 106(o)(Na)=2×23:106=0,43×100=43%(o)(C)=1×12:106=0,11×100=11%(o)(O)=3×16:106=0,45×100=45%3.
3. Որոշել նատրիումի կարբոնատում Na₂CO₃ ածխածնի օքսիդացման աստիճանը:
Na₂CO₃
O=-2*3=-6
Na=+1*2=+2
C=+4
+4+(+2)=+6
+6-(-6)=0
4 .Սովորի՛ր
Կենսաբանություն
Շարունակում ենք ուսումնասիրել ժառանգական հիվանդությունները 1, հեմոֆիլիա, դալտոնիզմ , 2րդ տիպի շաքարային դիաբետ դրանց ախտանիշները հնարավոր բուժումը, փոխանցման ճանապարհները, վտանգը:
Ժառանգական հիվանդություններ, մարդկանց ժառանգական հիվանդությունները բազմաբնույթ դրսևորումներ ունեն։ Ներկայումս այդ հիվանդությունների լիարժեք դասակարգում չկա, քանի որ դժվար է որոշել այս կամ այն ժառանգական ախտաբանության հիմքում ընկած չափանիշների շրջանակը, որոնցով հնարավոր է դրանք տարբերակել։
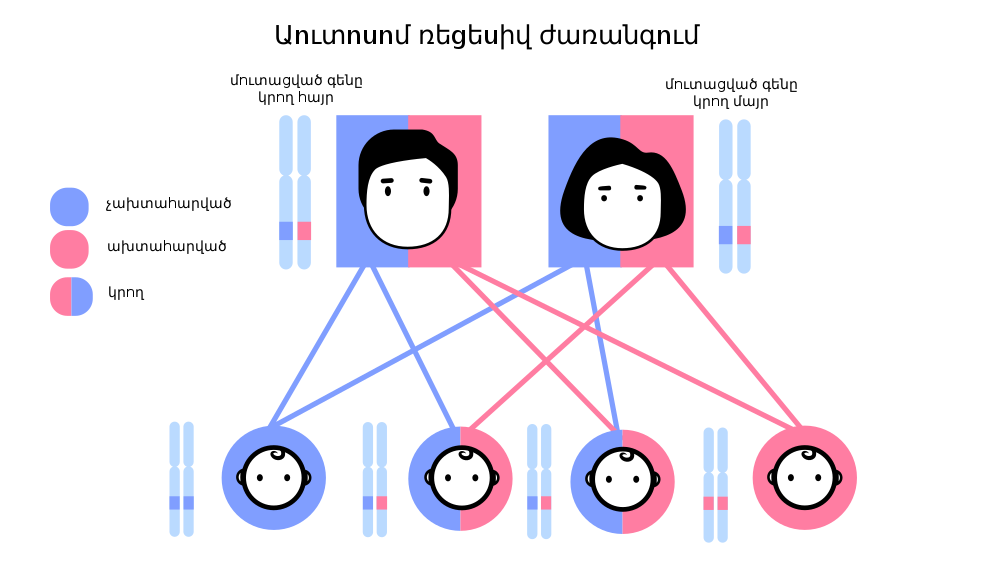
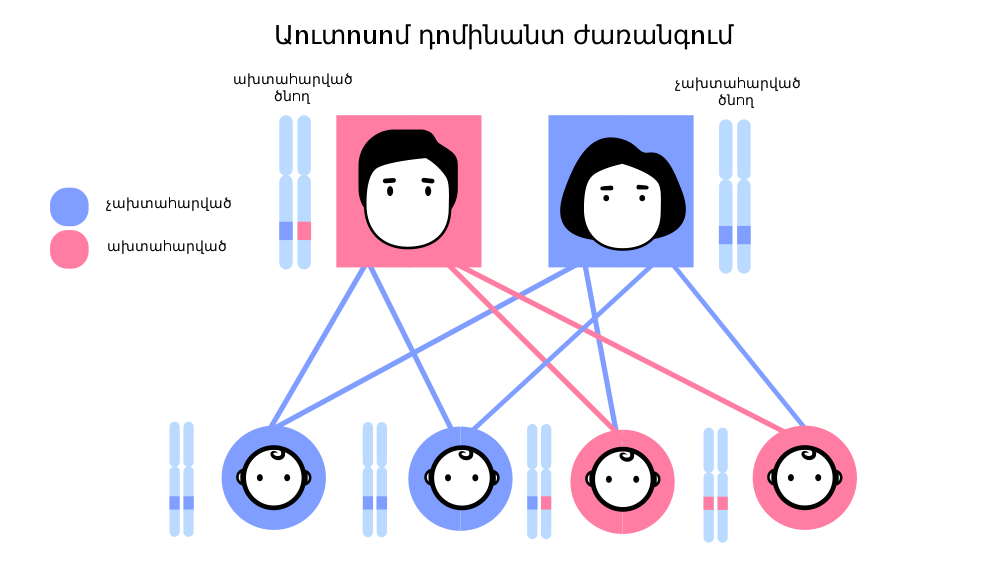
Ժառանգական հիվանդությունների մեծ մասի հիմքում ընկած է որոշակի գենի մուտացիան։ Մուտացիայի ենթարկված գենի գործունեության արդյունքում սինթեզվում է փոփոխված կառուցվածքով սպիտակուց (ֆերմենտ), որն էլ հանգեցնում է նյութափոխանակային գործընթացների շղթայի համապատասխան փուլի խանգարումների։ Այդպիսի փոփոխություններն անվանում են «մետաբոլիզմի բնածին խանգարումներ»։ Ներկայումս հայտնի են մարդու ավելի քան 3000 ժառանգական հիվանդություններ։ Դրանց մի մասը որոշվում են այնպիսի գեներով, որոնց գործունեությունը կախված չէ միջավայրի պայմաններից։
Հեմոֆիլիա, կոագուլոպաթիաների ամենատարածված ձևերից է։ Հիվանդությունը ժառանգական բնույթ ունի և անցնում է սերնդից սերունդ, ընդ որում հիվանդանում են միայն տղաները։ Հեմոֆիլիայով տառապող սերնդի կանայք գործնականորեն լինում են առողջ և միայն հիվանդության փոխանցողների դեր են կատարում։ Կին հաղորդիչները հեմոֆիլիան կարող են փոխանցել ոչ միայն իրենց տղա երեխաներին, այլև աղջիկ հաղորդիչների միջոցով նաև տղա թոռներին, ծոռներին և ավելի ապագա սերունդներին։
արբերում են A, B, C հեմոֆիլիաներ։ A հեմոֆիլիայի դեպքում հիվանդի արյան մեջ բացակայում կամ նվազում է (30%-ից պակաս) հակահեմոֆիլիային գլոբուլինը (VIII գործոն)։ B հեմոֆիլիայի դեպքում բացակայում է թրոմբոպլաստինի պլազմային բաղադրիչը (9 գործոն), իսկ C հեմոֆիլիայի դեպքում՝ III պլազմային գործոնը (XI գործոն)։ Գոյություն ունի նաև D հեմոֆիլիա, որը պայմանավորված է Խագեմանի գործոնի անբավարարությամբ։
Հեմոֆիլիայի կլինիկական երևույթները կարող են ի հայտ գալ կյանքի առաջին տարում, բայց արյունահոսությունը հաճախ առաջանում է այն ժամանակ, երբ երեխաները սկսում են քայլել և ենթարկվում են զանազան կենցաղային վնասվածքների։ Կրծքի տարիքում արյունահոսության հազվադեպ լինելը բացատրվում է նաև նրանով, որ կնոջ կաթը բավարար քանակությամբ ակտիվ թրոմբոկինազա է պարունակում։
Արյունահոսություններն առաջանում են կամ վնասվածքից անմիջապես հետո, կամ որոշ ժամանակ անց։ Ուշագրավ է այն հանգամանքը, որ երբեմն նույնիսկ չնչին վնասվածքները (լեզվի կծելը, ատամի ընկնելը և այլն) կարող են առաջացնել ուժեղ և տևական արյունահոսություններ, որոնք կարող են նույնիսկ կյանքին սպառնացող բնույթ կրել։ Արյունահոսությունները հաճախ լինում են քթից, լնդերից, բերանի լորձաթաղանթներից և այլն։ Ուժեղ արյունահոսություններ կարող են լինել ատամի հեռացումից, նշիկազատումից և այլ միջամտություններից։
Ենթամաշկային արյունազեղումներն արտահայտվում են տարբեր մեծության կապտուկների ձևով։ Կարող են նաև հեմատոմաներ դիտվել։ Լայնածավալ արյունակուտակումների ներծծման փուլում հիվանդի մոտ առաջանում են ընդհանուր թուլություն, ջերմության բարձրացում և այլ երևույթներ։ Կարող է ի հայտ գալ մաշկի դեղնություն, ուրոբիլինամիզություն։ Միջմկանային հեմատոմաները սովորաբար ավելի դանդաղ են ներծծվում։
Դալտոնիզմը սովորաբար բնածին վիճակ է, որն առաջանում է գենետիկական արատների պատճառով: Սակայն այն կարող է դրսևորվել նաև կյանքի ընթացքում` աչքի վնասվածքի, տեսողական նյարդի հիվանդությունների պատճառով, նաև օրգանիզմի տարիքային փոփոխությունների արդյունքում:
Դալտոնիզմը կամ գունային կուրությունը ոչ թե հիվանդություն է, այլ տեսողության առանձնահատկություն, երբ մարդը չի կարողանում տարբերել գույներն ու երանգները: Դալտոնիզմը XVIII դարի վերջին առաջին անգամ նկարագրել է Ջոն Դալտոնը: Նա ի ծնե չէր տարբերում կարմիր և կանաչ գույնի երանգները և դա գիտակցեց միայն 26 տարեկանում, ինչից հետո էլ սկսեց ուսումնասիրել այս թեման: