Սովորել`էջ 3-5
Ատոմի կառուցվածքը
Էլեկտրական երևույթները բացատրելու համար անհրաժեշտ է պարզել ատոմի կառուցվածքը: Այդ ուղղությամբ առաջին հայտնագործությունը կատարեց անգլիացի գիտնական Ջ. Թոմսոնը: 1898 թվականին նա հայտնաբերեց ատոմի կազմի մեջ մտնող և տարրական լիցք կրող փոքրագույն մասնիկը՝ էլեկտրոնը:

Էլեկտրոնի լիցքը՝ qe=−e=−1,6⋅10−19Կլ, իսկ զանգվածը՝ me=9.1⋅10−31կգ
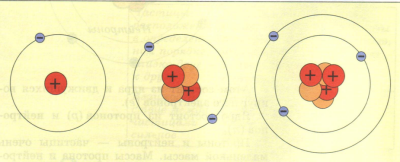
Էլեկտրոնը անհնար է «զատել» իր լիցքից, որը միշտ միևնույն արժեքն ունի: Տարբեր քիմիական տարրերի ատոմներում պարունակվում են տարբեր թվով էլեկտրոններ: Շարունակելով ատոմի կառուցվածքի բացահայտման հատուկ փորձերը, անգլիացի գիտնական Էռնեստ Ռեզերֆորդը 1911թ.-ին ներկայացրեց ատոմի կառուցվածքի վերաբերյալ իր մոդելը, որն անվանեցին մոլորակային:

Ըստ Ռեզերֆորդի նյութի՝ յուրաքանչյուր ատոմ կարծես փոքրիկ Արեգակնային համակարգ է, որի կենտրոնում դրականապես լիցքավորված միջուկն է: Էլեկտրոնները պտտվում են միջուկի շուրջը նրա չափերից շատ ավելի մեծ հեռավորությունների վրա, ինչպես մոլորակները Արեգակի շուրջը:
Էլեկտրոնները շարժվում են արագացմամբ (մոտ 1022մ/վ2), որի պատճառը միջուկի և Էլեկտրոնի փոխադարձ ձգողությունն է: Էլեկտրոնի և միջուկի գրավիտացիոն փոխազդեցությունը շատ փոքր է` մոտ 10−40ն, հետևաբար նրանց փոխազդեցությունը հիմնականում էլեկտրամագնիսական բնույթի է:
Սովորական վիճակում մարմինը, ինչպես և նրա կառուցվածքային տարրերը՝ ատոմները, էլեկտրաչեզոք են: Ուրեմն վերջինիս բոլոր էլեկտրոնների գումարային լիցքի բացարձակ արժեքը հավասար է միջուկի լիցքին:
Տարբեր տարրերի ատոմները միմյանցից տարբերվում են իրենց միջուկի լիցքով և այդ միջուկի շուրջը պտտվող Էլեկտրոնների թվով:
Դ. Ի. Մենդելեևի քիմիական տարրերի պարբերական աղյուսակում տարրերի կարգաթիվը՝ Z-ը, համընկնում է սովորական վիճակում տվյալ տարրերի ատոմի մեջ պարունակվող էլեկտրոննեի թվի հետ, հետևաբար էլեկտրոնների գումարային լիցքը ատոմում հավասար է՝
qէլ.=−Z⋅e
Միջուկի լիցքը կլինի՝
qմիջ.=+Z⋅e
Ատոմի միջուկը ևս բարդ կառուցվածք ունի. նրա կազմության մեջ մտնում են տարրական դրական լիցք կրող մարմիններ՝ պրոտոններ:qp=e=1,6⋅10−19կլ
Պրոտոնի զանգվածը մոտ 1840 անգամ մեծ է էլեկտրոնի զանգվածից: Դատելով միջուկի լիցքից կարելի է պնդել.
Ատոմի միջուկում պրոտոնների թիվը հավասար է տվյալ քիմիական տարրի կարգահամարին՝ Z-ին:
Ինչպես ցույց տվեցին հետազոտությունները, բացի պրոտոններից միջուկի պարունակում է նաև չեզոք մասնիկներ, որոնց անվանում են նեյտրոններ:
Նեյտրոնի զանգվածը փոքր ինչ մեծ է պրոտոնի զանգվածից: Նեյտրոնների թիվը միջուկում նշանակում են N տառով:
Միջուկի պրոտոնների՝ Z թվի և նեյտրոնների N թվի գումարին անվանում են միջուկի զանգվածային թիվ և նշանակում A տառով:
A=Z+N, որտեղից՝ N=A−Z
A-ն կարելի է որոշել Մենդելեևի աղյուսակից՝ կլորացնելով տրված տարրի հարաբերական ատոմային զանգվածը մինչև ամբողջ թիվ:
Այսպիսով, ատոմի կենտրոնում դրական լիցք ունեցող միջուկն է, որը կազմված է Z պրոտոնից և N նեյտրոնից, իսկ միջուկի շուրջը, եթե ատոմը չեզոք է, պտտվում են Z Էլեկտրոններ:
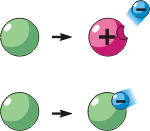
Որոշ դեպքերում ատոմները կարող են կորցնել մեկ կամ մի քանի էլեկտրոններ: Այդպիսի ատոմն այլևս չեզոք չէ, այն ունի դրական լիցք և կոչվում է դրական իոն: Հակառակ դեպքում, երբ ատոմին միանում է մեկ կամ մի քանի էլեկտրոն, ատոմը ձեռք է բերում բացասական լիցք և վեր է ածվում բացասական իոնի: